| 研究テーマ 脳の発生・発達の分子メカニズムの解明とその応用 |
我々が周辺の環境を認知し、物を考え判断し行動するなどあらゆる脳の機能は、精巧に形づくられた神経回路網のうえに成り立っている。神経細胞が適切な場所に移動し、配置され、正しい相手と結びつくことによって、神経回路網が形成されてゆく。この過程に問題があれば、様々な疾患の原因と成り得る。神経再生医療を考えるならば、神経幹細胞から神経細胞を作り出す技術のみならず、神経回路形成の仕組みを理解し、それを応用する必要がある。
我々の研究室では、神経細胞が作り出される仕組み、神経細胞移動、神経回路形成、機能発現の分子メカニズムの解明を目指しています。そのため、マウスやゼブラフィッシュなどを用いて、個体レベルで脳の発生・発達段階での遺伝子の機能を解析しています。こうした研究成果が神経疾患の治療法の開発や、神経再生医療への応用に結びつくことを目指しています。また、記憶・学習のメカニズムや情動系などの我々の脳のもつ高次機能の成り立ちの仕組みの理解を深めることで、神経・精神疾患の分子・細胞基盤の理解を深め、こうした疾患の治療に寄与することが期待されます。
神経系の形成過程における神経細胞の移動・位置決定および形態形成を司る分子機構の解析
神経系が正常に機能するためには、神経系の形成過程において、神経細胞が正しい位置に移動して分化し、軸索や樹状突起などを伸長させ、正しい相手の神経細胞と結びついて神経回路を形成する必要がある。Cyclin-dependent
kinase 5 (Cdk5)は神経細胞の移動・位置決定、神経突起伸長、軸索ガイダンスなど、神経系の形成過程の様々な局面で、重要な働きを担っていることが明らかとなっている。Cdk5,
p35欠損マウスなどを用いて、Cdk5/p35の機能を解明し、関連するタンパク質(リン酸化する基質タンパク質など)の機能を明らかにすることで、こうした神経系の形成過程の分子機構に迫ろうとしている。さらに、我々がCdk5の基質として同定したCRMP2を中心として、そのリン酸化による機能制御を、個体レベルで明らかにしようとしている。また、ゼブラフィッシュにおいては、脊髄の形成期に一過性に出現するRohon-Beard感覚神経細胞をモデルとして、CRMPファミリーが脊髄内における神経細胞の位置決定および神経軸索伸張に果たす役割についての解析を行っている。 |
1.jpg) |
脳高次機能の遺伝子改変マウスを用いた分子機構の解析
Cdk5/p35はプレシナプスやポストシナプスにおいて、シナプス可塑性に関与する様々なタンパク質をリン酸化することが報告されてきたが、p35欠損マウスやCdk5 コンディショナルKOマウスの解析などから、マウス個体レベルでも、Cdk5/p35の脳高次機能への関与が明らかにされてきている。
本研究室では、Cdk5, p35遺伝子の改変マウスを用いて、記憶・学習、情動などの大脳高次機能へのCdk5/p35の関与を切り口に、リン酸化シグナルに焦点を当てて研究を進めている。
|
成魚脳における神経幹細胞の増殖・分化を司る制御機構の解析
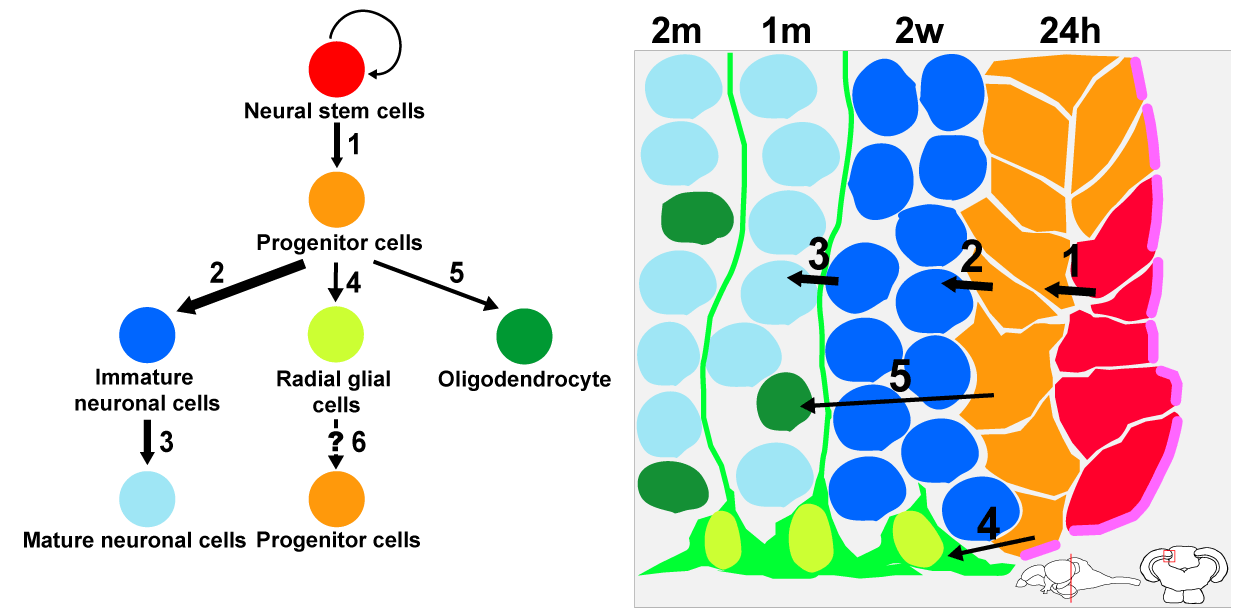
哺乳類において成体脳における神経の新生は記憶学習に重要な役割を果たしている。また、これまで中枢神経系の損傷に伴う機能喪失からの回復は不可能と考えられてきたが、神経幹細胞の移植により中枢神経系の機能の修復が起きる事例が報告され始め、神経幹細胞の増殖・分化の制御手法の確立は再生医療の観点からも重要な課題である。
ゼブラフィッシュなどの硬骨魚類の成魚脳では様々な領域に神経幹細胞が分布し、生涯にわたり新生神経細胞が供給されている。我々は視神経の投射先である視蓋に分布する神経幹細胞に注目し、これらの増殖・分化のメカニズムの解析を通して神経幹細胞の維持および分化誘導の一般原理の解明を目指している。
|
 |
ヒト神経・精神疾患の病因・病態の解明、治療法の開発に向けた研究
神経変性疾患は、一部の家族例の解析より、原因遺伝子の同定がなされているが、依然その病因・病態には不明な点が多く残されている。
本研究室では、Cdk5の欠損モデルにおける神経細胞変性・脱落の病態をモデルに、神経変性疾患の病態解明に関する試みを行なっている。また、アルツハイマー病モデルマウス、薬剤投与によるパーキンソン病モデル、脊髄損傷モデルなどを用いて研究を進めている。
|
CRMPをターゲットにした神経疾患の治療法の開発
神経疾患の治療の難しさは、中枢神経系における神経再生の起こり難さにある。その理由の一端は神経再生に抑制的に働く分子機構にあり、阻害因子としてのミエリン関連因子myelin-associated inhibitors (MAI) やセマフォリンの存在、それを受容する機構(受容体)、それを伝える細胞内制御機構の存在が挙げられる。阻害因子やそれらの受容体をターゲットとした治療法の開発を目指した研究が行われているが、実用化に至っていない。その理由としては、これら阻害因子は多様な生理機能があるため、それをターゲットとした治療は副作用の問題が生ずる可能性があるからである。我々は、阻害因子の細胞内制御機構に係るCRMPに着目して、その機能修飾を行なうことで、神経再生を促すことをin vivoの実験系で示すことにより、CRMPをターゲットとした治療戦略を検証している。CRMP (Collapsin Response Mediator Protein) にはCRMP1-5があり、CRMP1-4はアミノ酸配列のホモロジーが高く、ヘテロ4量体を形成して機能する可能性が指摘されるなど、機能的なredundancyが想定される。また、セマフォリン3A (chick Sema3Aの旧名称がCollapsin) の細胞内シグナル伝達に関与する分子として同定されている。再生阻害因子の内、セマフォリン3Aの細胞内シグナル伝達にはCRMP2のリン酸化が関与し、CSPGなどのMAI の細胞内シグナル伝達にはCRMP4が関与することが先行研究から明らかになっていた。我々は、CRMP2KIマウスとCRMP4KOマウスにおいて、脊髄損傷後の神経再生が野生型に比べて良好であることを見出している。また、MPTP投与により作成したパーキンソン病マウスモデルにおいて、CRMP4欠損マウスでは中脳黒質のドーパミン神経細胞死が野生型に比べて抑制されていることを見出している。CRMP2と相互作用するタンパク質間の結合を調整する薬剤LKEを投与することにより脊髄損傷からの回復が良好になることも見出している。 |
|
|
|


